中国医疗器械市场准入研究
2018.01.22 马锋 王超
一、中国医疗器械监管法规体系
1、监管机构
食品药品监督管理部门(各级FDA)、卫生计生主管部门
2、监管范围
产品准入监管(包括对产品研发、型式检验、临床试验、产品注册/备案等的监管)
产品上市后监管(对产品生产、经营、使用等的监管)
3、法规体系

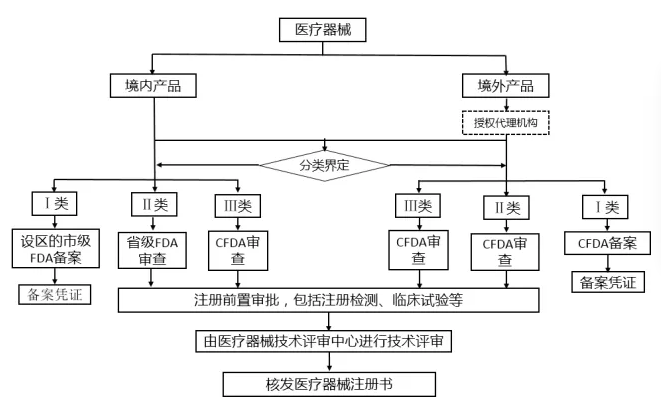
二、医疗器械注册/备案的一般审批程序
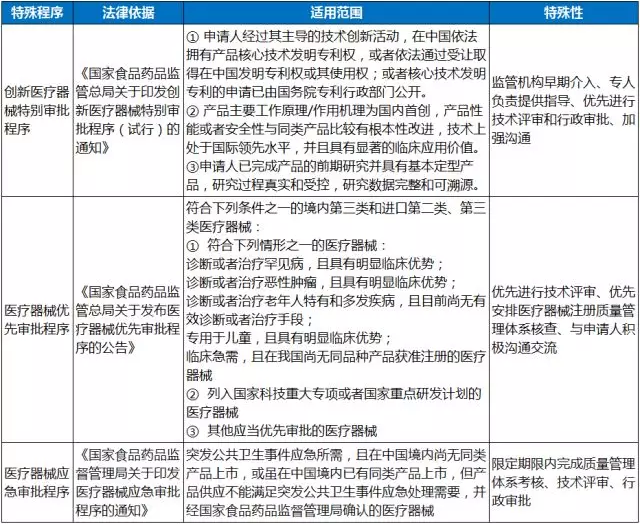
三、医疗器械的特别审批程序
四、医疗器械注册/备案需要提交的资料
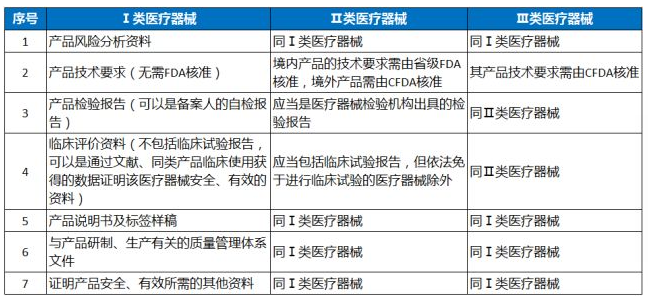
另外,申请注册或者办理备案的进口医疗器械,还应当提交相关产品在申请人或者备案人注册地或者生产地址所在国家(地区)已获准上市销售的证明文件。
五、医疗器械准入的主要法律问题—代理人制度
代理人制度
《医疗器械注册管理办法》第十四条第一款规定“境外申请人或者备案人应当通过其在中国境内设立的代表机构或者指定中国境内的企业法人作为代理人,配合境外申请人或者备案人开展相关工作。”
代理人的职责(《医疗器械注册管理办法》第十四条第二款)
办理医疗器械注册或者备案事宜:
与相应食品药品监督管理部门、境外申请人或者备案人的联络;
向申请人或者备案人如实、准确传达相关的法规和技术要求;
收集上市后医疗器械不良事件信息并反馈境外注册人或者备案人,同时向相应的食品药品监督管理部门报告;
协调医疗器械上市后的产品召回工作,并向相应的食品药品监督管理部门报告;
其他涉及产品质量和售后服务的连带责任。
境内代理人的选择及代理协议
代理人的常见选项
境外医药企业在中国境内设立的代表机构、关联公司
优点:利于保护知识产权、技术秘密、商业秘密等
不足:能力资源有限,可能难以承担代理人的全部职责
中国境内的医疗器械经销商
优点:丰富的本地资源,便于开拓市场
不足:可能导致技术及商业秘密外泄,知识产权受侵害
起草代理协议时的注意事项
代理方式的选择
代理人的职责定位
境外企业的知识产权、技术及商业秘密的保护
境外企业与代理人关于产品质量和售后服务责任的分担
其他合规问题(如商业贿赂、反垄断问题)
六、医疗器械准入的主要法律问题——临床试验
临床试验中的各方当事人及法律关系
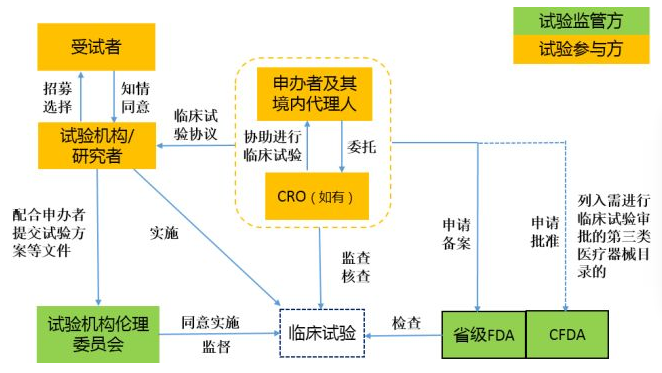

临床试验中的法律服务
文件起草
申办者与临床试验机构之间的临床试验协议
申办者与合同研究组织(CRO)之间的临床试验服务协议
临床试验机构与受试者之间的参与试验协议
与监管机构的沟通
协助办理临床试验的备案和核准
协助配合食品药品监管部门、伦理委员会的监督检查
发生不良事件时的处理
应对受试者提起的诉讼或仲裁
对受试者的损害赔偿
发生不良事件时对受试者的损害赔偿责任
赔偿主体
侵权责任:申办者对受试者承担无过错责任,研究机构负有过错责任(存在争议)
违约责任:申办者与受试者之间成立合同关系,受试者可追究申办者的违约责任
因果关系
受试者受到的损害与临床试验之间的因果关系可能难以确定,往往成为案件争议的焦点
赔偿标准
通常援引《最高人民法院关于审理人身损害赔偿案件适用法律若干问题的解释》
法官根据具体案情行使自由裁量权,酌定赔偿金额
保险理赔
申办者购买保险为开展临床试验的前置条件
保险理赔存在局限性,并不能完全替代申办者对受试者或其家属直接的赔偿
《医疗器械临床试验质量管理规范》第四十八条
“申办者应当为发生与临床试验相关的伤害或者死亡的受试者承担治疗的费用以及相应的经济补偿,但在诊疗活动中由医疗机构及其医务人员过错造成的损害除外。”
某患者诉某医药公司及某医院合同纠纷案
基本案情
某医药公司研制开发了一种新药,经CFDA批准后,与2006年3月与某医院签订临床试验协议正式开始临床试验。某患者从2006年10月23日开始服用该药,参与临床试验,后发生严重不良事件。
该医药公司在保险公司为该药品的临床试验进行了投保,每个受试者的最高保额为50万欧元。但由于该医药公司未向保险公司提供证明患者健康损害的有关证据,该患者最终未能获得保险赔付。该患者遂以医药公司和医院为共同被告提起诉讼,要求其承担损害赔偿责任。
北京市朝阳区法院及北京市二中院的判决要旨
因医院与医药公司之间存在临床试验协议,医药公司委托医院开展临床试验,原告患者作为受试者,与医药公司之间形成了新药试验合同关系,诉争合同主体应确定为医药公司和患者。
由于医药公司未能通过保险公司向患者赔偿发生严重不良事件的赔付款项,故其应自行向患者进行赔偿。关于具体赔偿数额,法院考虑患者的受损情况,严重不良事件对其自身的影响以及50万欧元(保险)所能赔偿的最坏损害情况,最终酌定赔偿额为5万欧元。
* 此案虽为药品临床试验相关的诉讼纠纷,但对医疗器械同样具有参考价值。
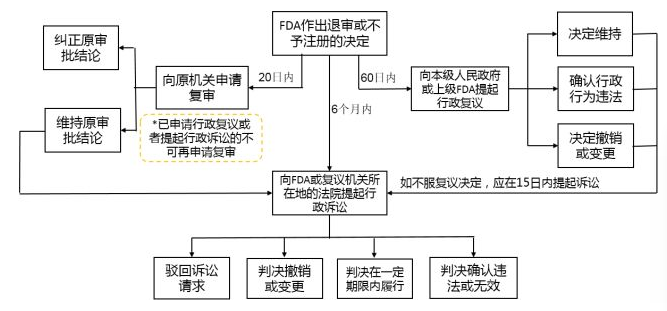
七、医疗器械准入的主要法律问题—救济措施
复审、行政复议、行政诉讼
河南依生药业有限公司诉CFDA药品注册审批案
基本案情
依生药业公司提出的某疫苗产品的临床试验申请未被CFDA批准,依生药业公司不服,起诉至法院,请求法院撤销CFDA作出的不予批准临床试验的审批通知,并判令CFDA作出批准依生药业公司申请项目进入临床试验的许可
北京市一中院及北京市高院的判决要旨((2015)高行终字第1002号)
确认CFDA在药品注册审批过程中存在违反正当法律程序及超过法定许可期限的程序违法问题
鉴于CFDA已经针对依生药业公司提出的申请作出最终处理决定且结论并无不当,如仅以程序违法为由判决撤销被诉审批通知,责令CFDA重新进行审查并作出决定,不仅无益于依生药业公司的实体权利救济,而且会浪费行政资源,有损于公共利益。鉴此,应判决依法确认CFDA作出的被诉审批通知违法,但对于依生药业公司提出的撤销被诉审批通知,并判令CFDA作出批准依生药业公司申请项目进入临床试验的许可之诉讼请求,不予支持。
* 此案虽为药品注册相关的诉讼纠纷,但对医疗器械注册同样具有参考价值。











