创新医疗器械特别审批程序即将实施
2014.02.25 周烽 高晗婷
2013年3月20日,国家食品药品监管总局(以下简称“国家食药监局”)公开《创新医疗器械特别审批程序(试行)(征求意见稿)》(以下简称“《征求意见稿》”),向公众征求意见。由于创新医疗器械在注册时可以享受专人负责、优先办理等便利,可能实质性缩短冗长的医疗器械注册流程,《征求意见稿》一经公开便得到了医疗器械行业的普遍关注和积极反馈。2014年2月7日,经过进一步修改完善,国家食药监局公布了正式的《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号,以下简称“《特别审批程序》”)。该规章将于2014年3月1日起正式施行。
一、何谓“创新医疗器械”?
根据《特别审批程序》,创新医疗器械是指同时符合下列三个条件的医疗器械:
(a) 申请人经过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开;
(b) 产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值;且
(c)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
与《征求意见稿》相比,《特别审批程序》实质性扩大了“创新医疗器械”的范围。具体而言,《征求意见稿》要求申请人对于产品的核心技术具有自主知识产权,且明确该等“自主知识产权”是指具有产品核心技术的发明专利权或者发明专利权的使用权。《特别审批程序》则规定,除具有上述两项权利外,“核心技术发明专利的申请已由国务院专利行政部门公开的”也属于申请人具有自主知识产权的情形。根据我国《专利法》,发明专利通过形式审查的,自申请日起满十八个月,即行公布,申请人还可申请提前公开。发明专利申请人从专利被公开到被授予专利权,通常至少还需要1年半的时间。允许“创新医疗器械”包括那些技术专利的申请已被公开还未被授予专利权的产品,意味着申请人可以更早地申请其产品适用创新医疗器械的特别审批流程。
二、创新医疗器械特别审批程序同一般医疗器械审批程序的区别
我国对医疗器械实行分类注册管理制度,将医疗器械分为一类、二类和三类医疗器械。除一类医疗器械的注册程序比较简单以外,第二、三类医疗器械一般都必须经过医疗器械注册检测、医疗器械临床试验以及医疗器械注册申请与审批这几个阶段。对比医疗器械的一般审批程序,创新医疗器械的特别审批程序主要“特别”在以下两个方面:
1. 适用创新医疗器械特别审批程序需经过申请
申请人如果希望其产品适用创新医疗器械特别审批程序,必须向省级食品药品监督管理部门或者国家食药监局提出申请。只有提交相关材料并经过审批确认其产品符合本文第一部分所述创新医疗器械的各项条件,申请人的产品才可以适用特别审批程序注册其医疗器械。
根据《特别审批程序》,境内申请人和境外申请人分别适用不同的审批流程。具体见于下图:
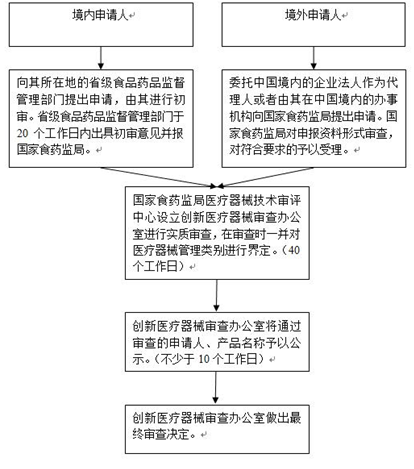
在《征求意见稿》阶段,国家食药监局曾规定申请人必须“为中国境内的企业法人,产品在中国境内生产,并具有医疗器械生产企业许可证”。这一度引起一些在中国销售医疗器械,但是没有生产工厂的外国医疗器械生产企业的担忧。《特别审批程序》取消了这项并不合理的要求,允许境外申请人就其医疗器械申请适用特别审批程序,不要求产品必须在中国境内生产,对于外国医疗器械生产企业无疑是一项利好。
2. 早期介入、专人负责、科学审批
创新医疗器械的特别审批程序不是一项独立于医疗器械一般审批程序以外的审批程序,也没有减少任何审批环节或降低任何标准,而是在一般审批程序的各个环节贯彻早期介入、专人负责、科学审批的原则,要求关涉创新医疗器械的行政审批予以优先办理,并加强与申请人的沟通交流。
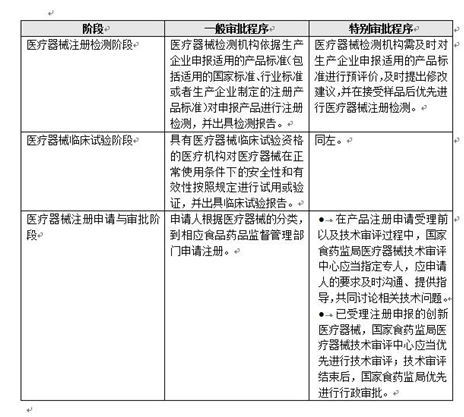
下表为最常见的第二、第三类医疗器械注册的一般审批流程和创新医疗器械的特别审批流程的对比:
三、简评
1、为创新医疗器械设定特别审批程序有利于促进医疗器械的研究与创新
《特别审批程序》是国家食药监局为促进医疗器械创新发展而推出的重要措施,将对鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展起到积极作用。与《征求意见稿》相比,《特别审批程序》允许“创新医疗器械”包括那些技术专利的申请已被公开还未被授予专利权的产品,这有利于更多采用新技术的医疗器械更快推向市场并产生效益。国家食药监局特设创新医疗器械审查办公室,并要求医疗器械技术评审中心指定专人与申请人的沟通交流,将极大方便申请人就产品技术、安全性、临床试验方案、临床试验结果等重要问题同食药监部门保持密切沟通。
2、对境外医疗器械厂商是一个利好
与《征求意见稿》不同,《特别审批程序》不限制境外申请人申请适用特别审批程序,这对于外国医疗器械生产企业是一个利好。尽管如此,外国医疗器械生产企业必须充分重视其产品核心技术在中国的发明专利注册,只有提前进行专利布局,才能确保其产品适用该特别审批程序。
3、“创新医疗器械”的定义仍显原则性
《特别审批程序》对于“创新医疗器械”的定义仍显原则性,对于什么是产品性能或者安全性的“根本性改进”,什么是“显著的临床应用价值”,没有统一的标准。在国家食药监局对此进一步明确之前,这些内容存在较大的解释空间,尺度较难统一。
4、特别审批的效果有待观察
《特别审批程序》为创新医疗器械设定了早期介入、专人负责、优先审批、加强沟通等制度,但是强调“标准不降低,程序不减少”,没有就创新医疗器械设定较短的审批时限。对企业而言,其产品适用特别审批程序是否真的能在在实践中带来快捷和便利还有待验证。
在本文起草期间,《医疗器械监督管理条例(修订草案)》已于2014年2月12日经国务院常务会议审议通过,即将颁布实施。根据公开媒体报道,修订后的条例将对高风险产品提高门槛,对低风险产品简化准入手续;同时鼓励企业创新,开发更多优质产品。我们预期,修订后的条例会为《特别审批程序》提供一定的上位法支持,但不排除《特别审批程序》会根据修订后的条例进一步细化和完善。












