《港澳药械通》和《港澳中药通》简介及其实施情况回顾——写在法规落地一周年之际
2022.07.20 周烽 黄芷莲
一、引言
2019年2月18日,中共中央、国务院印发了《粤港澳大湾区发展规划纲要》,将生物医药列为重点培育产业之一。在该纲要的指导下,国家药品监督管理局(以下简称“国家药监局”)于2020年9月29日颁布《粤港澳大湾区药品医疗器械监管创新发展工作方案》(以下简称“《工作方案》”)。
《工作方案》提出了拟在大湾区实施的一系列药械监管创新政策,包括首次提出港澳药械企业可以委托粤港澳大湾区内地九市的企业进行跨境生产。该政策的实施方案已于今年6月29日正式落地,相关解读可参考君合此前的评论《境外持证人委托境内企业生产药品和医疗器械的通路开启——简评港澳药械企业跨境委托生产新政》。
《工作方案》中最为耀眼的另两项监管创新政策已于去年先行落地实施。2021年8月,国家药监局先后出台《广东省粤港澳大湾区内地临床急需进口港澳药品医疗器械管理暂行规定》(以下简称“《港澳药械通》”)和《广东省药品监督管理局关于简化在港澳已上市传统外用中成药注册审批的公告》(以下简称“《港澳中药通》”)。“两通”政策实施近一年来,已经有了多个落地案例,推动了粤港澳三地用药用械趋同和中成药发展,对于我国的医药监管创新也积累了可复制可推广的经验。
值此《港澳药械通》和《港澳中药通》出台一周年之际,本文将回顾《港澳药械通》和《港澳中药通》的主要内容,并对其实施情况进行总结,以便更多医药企业能够享受两项制度的红利。
二、《港澳药械通》的制度设计和实施情况
(一) 制度设计
根据我国《药品管理法》的要求,只有在药品监督管理部门完成注册的药品才能在中国上市,而根据我国《医疗器械监督管理条例》的要求,只有完成注册或备案的医疗器械才能在中国上市。由于这些前置要求,一些已在境外上市且我国临床急需的药械无法快速进入国内,及时满足国内医疗市场的需求。
根据《港澳药械通》的规定,对于临床急需进口港澳药品(以下简称“急需药品”)和临床急需进口港澳医疗器械(以下简称“急需医疗器械”)(合称为“急需药械”),经指定医疗机构申请,并经广东省药监局会同相关部门审批后,可在申请进口使用的医疗机构用于特定医疗目的。
我们对《港澳药械通》的基本要求梳理如下:
1、对急需药械、指定医疗机构、经营企业的基本要求
急需药品 | 急需医疗器械 | |
急需药械的品种范围 |
| 港澳公立医院已采购使用、属于临床急需、具有临床应用先进性的医疗器械。 |
指定医疗机构必须同时具备的条件 |
若医疗机构不属于港澳医疗卫生服务提供主体在大湾区设立的外商投资企业,但符合其他条件,拟申请纳入指定医疗机构的,由广东省卫健委参照上述条件研究后,报请国家卫健委审批确定。 | |
经营企业必须同时具备的条件 |
|
|
2、审批机关和职权划分
广东省药监局会同广东省卫健委共同建立评审专家库,对指定医疗机构提出的拟进口使用的急需药械进行评估审核;审核同意批准的,发批准文件,批准文件有效期1年。
我国药械监管法规允许医疗机构经批准后因临床急需进口少量药品和医疗器械1,但采用按需申请,限量进口的监管方式,对于进口药械的品种也有严格要求2。在《港澳药械通》机制下,广东省药监局和广东省卫健委被赋予了更为宽松的审批权限:(1)针对指定医疗机构首次申请急需药械,由广东省药监局和广东省卫健委确认审核后纳入粤港澳大湾区内地临床急需进口港澳药品医疗器械目录(以下简称“《目录》”);(2)针对指定医疗机构非首次申请已纳入《目录》的急需药械,只需要由广东省药监局确认审核。
3、临床真实世界数据可用于内地注册申报材料
与2019年4月海南省人民政府发布的《海南博鳌乐城国际医疗旅游先行区临床急需进口药品管理暂行规定》规定3类似,《港澳药械通》也允许医疗机构使用急需药械所收集的真实世界数据在符合要求的情况下用于我国药械注册。该项规定将真实世界数据运用在注册进行的临床评价,能够缩短港澳创新药械进入中国内地市场的时间,大大降低注册成本,使众多港澳创新药械企业更加积极地推动创新药械进入中国内地。
值得注意的是,相较于粤港澳大湾区对于急需药品的规定,海南博鳌乐城国际医疗旅游先行区还规定了临床急需进口药品的带离先行区使用的政策4,允许患者经相关审批后,将仅供自用、少量的口服临床急需进口药品带离先行区。目前粤港澳大湾区尚无相关政策。
(二)实施情况
1、急需药械审批概况
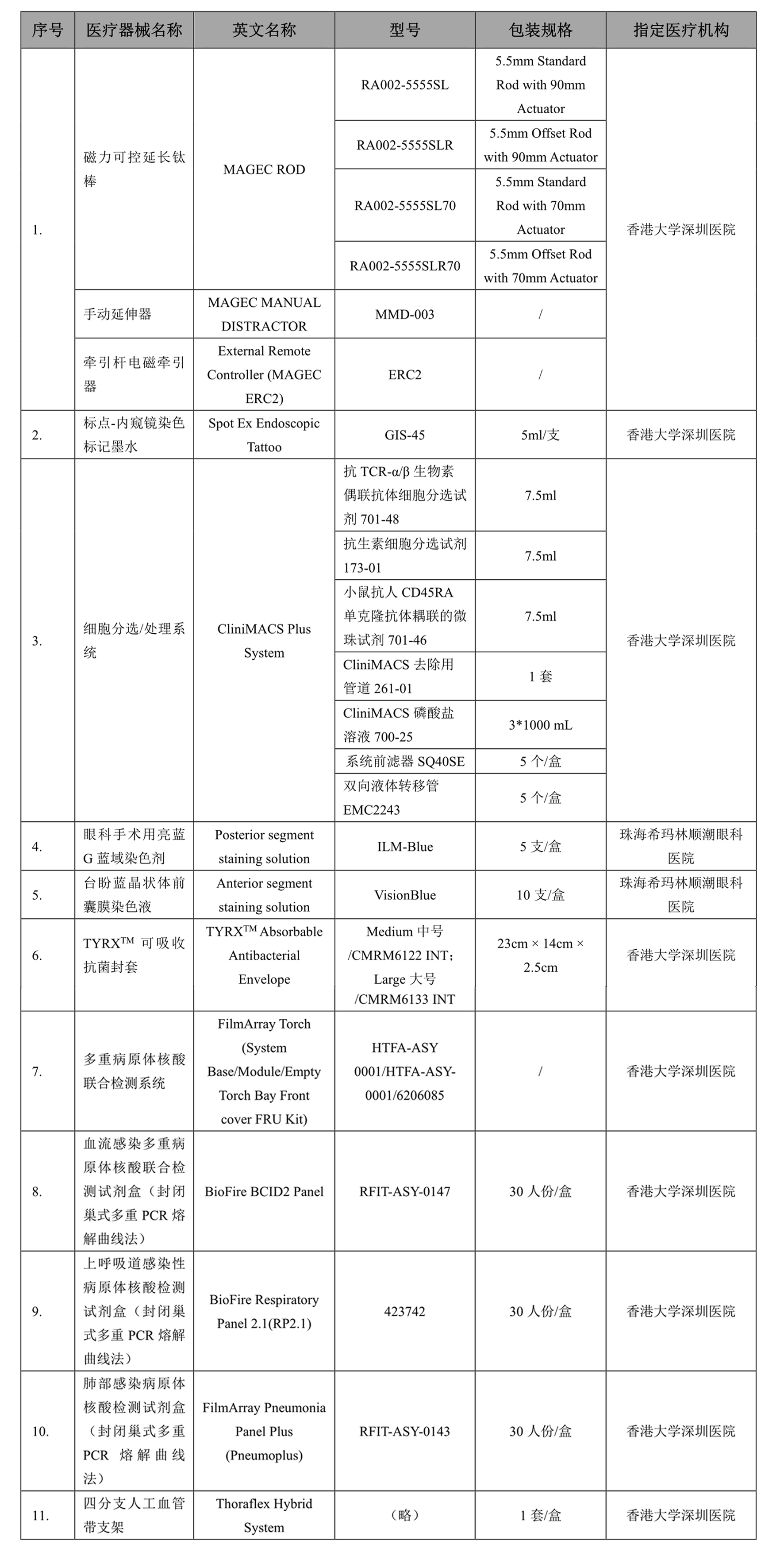
截至2022年7月中旬,广东省药监局和广东省卫健委已发布三批次《目录》,联合审批急需药品17个,急需医疗器械11个(参见附表一和附表二)。
获批的急需药械涉及产科、血液科、肿瘤科、骨科、眼科等多个科室的药械,包括了多款先进的原研药物如恩曲替尼、劳拉替尼、卡马替尼,针对黄斑变性疾病的布西珠单抗等。根据公开信息,引入品种在药品方面主要聚焦抗肿瘤新型原研药、罕见病用药、儿童用药、中毒急救药物、慢性病用药物等,而医疗器械将围绕眼科辅助用械、辅助听觉用械、外科手术用械等5。
2、申请急需药械的时限
根据广东省药监局公布的信息,首次申请进口使用急需药械的法定办结时限为35个工作日,承诺办结时限为20个工作日。广东省药监局也开通了线上办理渠道6,便利医疗机构的申请办理。对于非首次申请进口使用急需药械,广东省药监局公布了《粤港澳大湾区内地指定医疗机构非首次使用临床急需进口港澳药品医疗器械申报指南》,明确:(1)指定医疗机构申报本机构非首次使用的急需药械,法定办结时限为4个工作日;(2)指定医疗机构申报已纳入《目录》中的药品医疗器械,急需药品的法定办结时限为20个工作日,急需医疗器械的法定办结时限为25个工作日。相较于首次申请急需药械需要的法定时间更加简短,非首次申请急需药械的流程办理上更加简化。
3、指定医疗机构审批概况
截至目前,广东省卫健委综合考量医疗机构资质力量、合作建设医疗水平和所有制经营形式等因素,审核确定了首批5家内地指定医疗机构,涉及广州2家,深圳、珠海、中山各1家。具体为:香港大学深圳医院(三级医院,试点医院);广州现代医院(二级医院)、广州和睦家医院(二级医院)、珠海希玛林顺潮眼科医院(二级医院)和中山陈星海医院(三级医院)。据悉,目前多家医疗机构正在积极申报7,预计在未来会有更多的指定医疗机构将会公布。
4、利用真实数据获批内地上市的案例
根据广东省药监局的信息8,第一批急需药品目录中的洛拉替尼片(即劳拉替尼片)(英文名:Lorlatinib Tablets)已于2022年4月27日获批国内上市。洛拉替尼片是目前全球首个且唯一获批治疗间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)的第三代ALK抑制剂。
该药品在注册中使用了在大湾区收集的临床真实数据,成为国内首个使用大湾区真实数据获得注册的化学药品。目前,公开信息尚未能查到任何利用大湾区真实数据成功注册上市的医疗器械的案例。
三、《港澳中药通》的制度设计和实施情况
与《港澳药械通》不同,《港澳中药通》不是一项在经批准的有限范围内使用国内未上市药品的特殊安排,而是对来自港澳的已上市传统外用中成药的一项简化注册审批制度,一旦完成注册,相关中成药品种可以在全国范围内使用。
(一)制度设计
适用范围 |
| ||
调整审批事权 | 事项 | 《港澳中药通》落地前 | 《港澳中药通》落地后 |
注册审批(上市注册、上市后变更和再注册) | 国家药监局 | 广东省药监局 | |
技术审评、注册检验、通用名称核准和现场核查等各环节 | 国家药监局直属单位分开实施 | 广东省药监局组织实施 | |
简化申报材料 | 可提供原在港澳注册时提交的试验研究资料作为相应申报资料; 申请简化注册审批提交的产品处方和生产工艺申报资料应当与产品在港澳特区获准上市的资料一致; 应当提供皮肤过敏性和刺激性试验研究资料,但可不提供药物临床试验资料。 | ||
简化审批流程与时间 | 审批流程:
| ||
审批时间:
| |||
(二) 实施情况
由于港澳地区的中成药注册管理制度与内地不同,港澳企业对内地中成药的注册上市要求不熟悉,此前港澳中成药申报内地上市注册的并不多,《港澳中药通》的出台推动了港澳企业赴内地上市注册的积极性。
自《港澳中药通》发布以来,多家港澳企业积极向大湾区递交申请,目前共有5个港澳在售的传统外用中成药品种通过简化审批政策在内地上市(参见附表三)。11获批注册上市的中成药都是外用药,在港澳已上市多年,具有群众习用广泛和安全性相对较高等特点。通过简化审批在内地上市的港澳传统外用中成药为OTC非处方药,并标识有OTC标志,采用专门的药品批准文号格式,在原有国药准字ZC上增加“GD”(广东的字母缩写),即“国药准字ZCGD”便于大家辨别,相关购买渠道和其他内地上市药品一样,可以在医院或药店购买,为内地居民提供了购买便利。
此外,广东省药监局已通过广东省政务服务网发布了相关办事指南12,公开相关申报材料要求、办理流程、收费标准、联系电话等信息,为港澳企业申报提供相应的办事指引。相较于通常的中成药进口注册审批,在审批时限上大大缩短,审批总时限压缩一半,由原来的235日减至115日,极大地节省了港澳企业的时间成本。
四、结语
粤港澳大湾区覆盖香港、澳门和广东省九大城市,具有7000万常住人口。《港澳药械通》和《港澳中药通》的落地及实施对于推进粤港澳大湾区药品医疗器械监管创新发展,推动港澳同胞和大湾区内地民众医疗用药用械条件趋同,探索建立互动互利的药品医疗器械合作新模式具有重要意义。
通过《港澳药械通》政策进口药品和医疗器械,可以满足大湾区急需药械需求,而临床使用药械产生的真实世界数据,可以用于支持产品后续在国内注册上市。《港澳药械通》政策是继海南博鳌乐城国际医疗旅游先行区后国内第二个获批此政策的区域。尽管目前粤港澳大湾区在引进的急需药械的数量和利用真实世界数据在国内上市的药械数量均低于海南13,但凭借粤港澳大湾区庞大的临床资源和患者群体,该政策将为港澳药械企业和更广大的患者群体提供急需药械使用和注册的“大湾区方案”。
港澳地区传统中成药生产企业众多,当地市场规模有限。利用《港澳中药通》给予的简化注册审批政策,将助力港澳中药企业加快开拓内地市场,促进港澳地区做大做强中药产业。
附表一14
序号 | 药品名称 | 英文名称 | 规格 | 指定医疗机构 |
1 | 罗氟 司特片 | Roflumilast Tablets | 500μg | 香港大学深圳医院 |
2 | 恩曲替尼 胶囊 | Entrectinib Capsules | 100mg /200mg | 香港大学深圳医院 |
3 | 劳拉 替尼片15 | Lorlatinib Tablets | 25mg /100mg | 香港大学深圳医院 |
4 | 维泊妥组单抗注射液 | Polatuzumab Vedotin Infusion | 140mg | 香港大学深圳医院 |
5 | 氨己烯酸薄膜衣片 | Vigabatrin Film-coated Tablets | 500mg | 香港大学深圳医院 |
6 | 贝那利珠单抗预充式注射器注射液 | Benralizumab Solution For Injection In Pre-filled Syringe | 30mg/1ml | 香港大学深圳医院 |
7 | 卡博替尼薄膜衣片 | Cabozantinib Film-coated Tablets | 20mg /40mg /60mg | 香港大学深圳医院 |
8 | 阿培利司薄膜包衣片 | Alpelisib Film-coated Tablets | 200mg /200mg+50mg /150mg | 香港大学深圳医院 |
9 | 厄达替尼片 | Erdafitinib tablets | 3mg/4mg /5mg | 香港大学深圳医院 |
10 | 布地奈德缓释胶囊 | Budesonide Prolonged Release Capsules | 3mg | 香港大学深圳医院 |
11 | 布西珠 单抗 | Brolucizumab | 6m/0.05ml | 香港大学深圳医院 |
12 | 注射用羟钴胺素 | Hydroxocobalamin Powder For Solution For Infusion | 5g | 珠海希玛林顺潮眼科医院 |
13 | 卡马替尼 | Capmatinib | 150mg/200mg | 广州现代医院 |
14 | 伊匹木单抗注射液 | Ipilimumab Concentrate For Solution For Infusion | 50mg/10ml | 香港大学深圳医院 |
15 | 英克西兰 | Inclisiran | 284mg/1.5ml | 广州和睦家医院、中山陈星海医院、香港大学深圳医院 |
16 | 依瑞奈尤单抗 | Erenumab | 70mg/ml:1ml | 广州和睦家医院 |
17 | 巴氯芬注射液 | Baclofen Injection | 10mg/5ml | 香港大学深圳医院 |
附表二
附表三
序号 | 药品注册证书 | 国家/地区 | 中成药名称 | 持证人名称 |
1 | 国药准字ZCGD20210003 | 中国香港 | 紫花油 | 香港紫花油大药厂有限公司 |
2 | 国药准字ZCGD20210002 | 中国香港 | 和兴活络油 | 和兴白花油药厂有限公司 |
3 | 国药准字ZCGD20220002 | 中国香港 | 和兴白花膏 | 香港和兴白花油药厂有限公司 |
4 | 国药准字ZCGD20220001 | 中国香港 | 薄荷祛风油(十灵油) | 香港欧化药业有限公司 |
5 | 国药准字ZCGD20210001 | 中国澳门 | 张权破痛油 | 张权破痛油中药厂(澳门)有限公司 |
[1] 参见《中华人民共和国药品管理法(2019修订)》第六十五条第一款和《医疗器械监督管理条例(2021修订)》第五十七条第三款。
[2] 根据《临床急需药品临时进口工作方案》,临床急需进口的药品范围为:(1)用于治疗罕见病的药品;(2)用于防治严重危及生命疾病,且尚无有效治疗或预防手段的药品;(3)用于防治严重危及生命疾病,且具有明显临床优势的药品。根据《医疗器械监督管理条例(2021修订)》,临床急需进口的医疗器械范围为第二类和第三类医疗器械。
[3] 《海南博鳌乐城国际医疗旅游先行区临床急需进口药品管理暂行规定》琼府〔2019〕16号:第二十条 医疗机构应按照相关临床技术规范使用临床急需进口药品,并做好使用记录,所取得临床数据符合我国药品注册申报相关要求的,可供药品持有人在提交药品进口注册申请时作为申报资料,供国家药品审评部门参考。相关介绍可参见君合专题研究报告《海南自由贸易港医药医疗政策梳理和亮点解读》。
[4] 《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》琼药监综〔2020〕3号:第二条 本办法所指的临床急需进口药品带离先行区为先行区医疗机构患者出院时,由医疗机构根据患者需继续使用临床急需进口药品的实际情况,制定患者出院带药方案及应急预案,经省卫生健康主管部门审批,省药品监管部门批准后,患者可将仅供自用、少量的口服临床急需进口药品带离先行区,带离先行区的药品为患者已获批的临床急需进口药品。
[5] 广东省药品监督管理局:落地大湾区近一年 ,“港澳药械通”引进28个“救命”药械,http://mpa.gd.gov.cn/ztzl/dwq/mtbd/content/post_3962531.html。
[6] 广东政务服务网:临床急需港澳药品进口使用(首次申请),https://www.gdzwfw.gov.cn/portal/v2/guide/11440000MB2D0344212440172001001。
[7] 广东省药品监督管理局工作动态:http://mpa.gd.gov.cn/xwdt/sjdt/content/post_3500048.html。
[8] 广东省药品监督管理局 广东省卫生健康委员会关于发布第三批粤港澳大湾区内地临床急需进口港澳药品医疗器械目录的通告:http://mpa.gd.gov.cn/ztzl/dwq/wjjs/content/post_3964690.html。
[9]参见:http://mpa.gd.gov.cn/zwgk/jgsz/xzxkc/xgdt/content/post_3498457.html
[10]参见:http://mpa.gd.gov.cn/zwgk/jgsz/xzxkc/xgdt/content/post_3498457.html
[11] 信息来源于广东省药品监督管理局,《5个港澳传统外用中成药品种获批在内地上市》http://mpa.gd.gov.cn/xwdt/xwfbpt/mtzx/content/post_3912318.html 和《广东发放第二批港澳传统外用中成药内地上市注册证书》http://mpa.gd.gov.cn/zwgk/jgsz/xzxkc/xgdt/content/post_3908762.html。
[12] 广东政务服务网:港澳已上市传统外用中成药上市注册申请,https://www.gdzwfw.gov.cn/portal/v2/guide/11440000MB2D0344212440172002002。
[13] 截至目前,乐城引进临床急需进口药械227种,共有24个特许进口药品和医疗器械纳入乐城先行区真实世界数据应用试点。其中,有8个产品使用乐城真实世界数据获批上市,3个产品注册申请处于技术审评过程中。信息来源于海南省人民政府政务动态https://www.hainan.gov.cn/hainan/sxian/202207/177ff91fbeb04789b938cd4a6d551cf5.shtml。












